Siro Rodenas Cortes / Getty Images
Conclusiones clave
- Las vacunas COVID-19 están siendo revisadas por expertos durante su desarrollo y antes de que sean autorizadas por la Administración de Alimentos y Medicamentos.
- Al menos dos ensayos de vacunas se pausaron y luego se reiniciaron mientras los expertos revisaban los efectos secundarios que ocurrieron en los pacientes para determinar si éstos indicaban un problema con las vacunas.
- Una asociación de médicos negros y gobernadores de varios estados establecieron sus propios comités independientes de revisión de vacunas para revisar los datos disponibles sobre la seguridad y eficacia de las vacunas COVID-19 autorizadas.
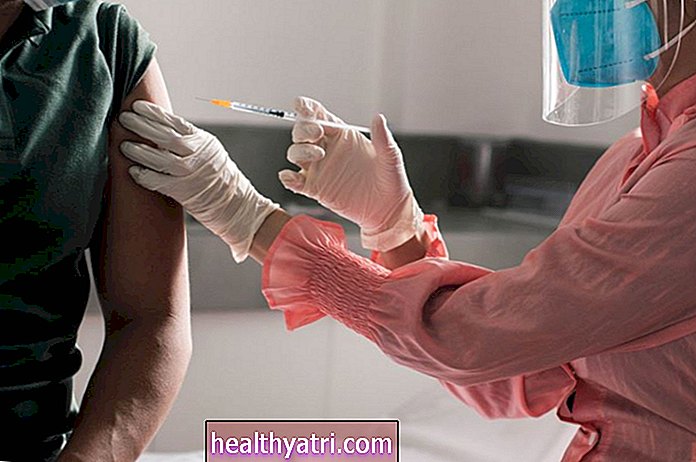
Han sucedido muchas cosas en el frente de la vacuna COVID-19 en poco tiempo. Nueve meses después de que comenzara la pandemia, los candidatos a vacunas de Pfizer y BioNTech y Moderna recibieron cada uno una autorización de uso de emergencia (EUA) de la Administración de Alimentos y Medicamentos (FDA). AstraZeneca, que también dio a conocer algunos datos sobre la eficacia de la vacuna, se está preparando para solicitar la autorización de uso de emergencia de la FDA.
Si bien los desarrollos son emocionantes, también asustan a algunos. Una encuesta de Verywell publicada en febrero encontró que el 51% de los estadounidenses dicen que no planean o no están seguros de recibir la vacuna COVID-19. Entre este grupo, la preocupación por los efectos secundarios y la preocupación por la eficacia son las razones más citadas para no querer vacunarse.
Los expertos en salud pública dicen que una pieza de información que debería disipar los temores del público es que las vacunas aceptadas por la FDA para ser revisadas para autorización de uso de emergencia no podrían haber llegado tan lejos sin la supervisión de un panel de científicos que son independientes de los fabricantes en desarrollo. la vacuna y los funcionarios del gobierno que la aprobarán. Estos científicos son miembros designados de las juntas de monitoreo de datos y seguridad (DSMB) que revisan los ensayos clínicos de medicamentos y vacunas.
"El DSMB supervisa los datos emergentes para proteger la seguridad de los sujetos de investigación y la integridad del ensayo [clínico]", dice a Verywell Elliott Antman, MD, médico senior especializado en medicina cardiovascular del Brigham and Women’s Hospital en Boston, Massachusetts. "Los miembros del DSMB recomiendan si un ensayo debe continuar según lo planeado, si se debe detener porque se han visto pruebas abrumadoras de beneficio o daño, o si los investigadores deben modificar el ensayo de alguna manera".
De acuerdo con las pautas del Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID), la rama de los Institutos Nacionales de Salud (NIH) que supervisa el desarrollo de varios candidatos a la vacuna COVID-19, un ensayo cuyas intervenciones pueden representar un riesgo para los participantes debe tener un DSMB.
¿Qué es un DSMB?
El NIAID define una junta de monitoreo de seguridad de datos (DSMB) como "un comité independiente que revisa los datos provisionales de seguridad y eficacia y brinda consejos para continuar, modificar o terminar el estudio".
Los DSMB han existido durante décadas para examinar nuevos medicamentos y vacunas, dice a Verywell Matthew Wynia, MD, MPH, director del Centro de Bioética y Humanidades del Campus Médico Anschutz de la Universidad de Colorado. “Los protocolos para garantizar la seguridad y eficacia de un estudio, y la seguridad de los participantes de ensayos clínicos, están bien establecidos”, dice.
DSMB y los candidatos a la vacuna COVID-19
Con base en el consejo de sus DSMB, tanto AstraZeneca como Johnson & Johnson, dos compañías que trabajan en vacunas COVID-19, detuvieron los ensayos clínicos cuando dos pacientes, uno inscrito en cada ensayo, experimentaron un efecto secundario grave. Ambos ensayos se han reanudado ahora, sobre la base de la determinación de las juntas de seguimiento de que los eventos adversos no indicaron un problema con las vacunas en términos de eficacia o seguridad. En el caso de AstraZeneca, un participante tuvo una respuesta inflamatoria que puede no estar relacionada con la vacuna. Johnson & Johnson no reveló el evento adverso específico.
Las vacunas Moderna y AstraZeneca se encuentran entre varias vacunas en desarrollo con fondos de los NIH. Un solo DSMB se ha reunido para todas las vacunas COVID-19 financiadas por los NIH, con su presidente elegido por el director del NIAID, Anthony Fauci. Los nombres de los miembros de DSMB se han mantenido en secreto, aparte del presidente (cuya universidad publicó su papel en línea y luego lo eliminó). Mantener los nombres en secreto ayuda a proteger a los miembros de DSMB de la presión empresarial o gubernamental.
Pfizer, que no recibió fondos del gobierno de los EE. UU. Para el desarrollo de su vacuna, estableció su propio DSMB. “El Comité de Monitoreo de Datos (DMC) está compuesto por un presidente y cuatro miembros adicionales. No damos a conocer los nombres de los miembros de DMC ", dijo a Verywell Jessica Pitts, directora de relaciones globales con los medios de comunicación de Pfizer, por correo electrónico. "Cuatro miembros son profesores de medicina actuales o anteriores de gran prestigio con amplia experiencia en enfermedades infecciosas pediátricas y adultas y seguridad de vacunas. Un miembro es un estadístico respetado con amplia experiencia en ensayos de vacunas".
Informes de DSMB hasta ahora
Moderna: El 16 de noviembre, el NIAID publicó un comunicado de prensa sobre la evaluación de DSMB del ensayo de vacuna de Fase 3 de Moderna. "Esta revisión intermedia de los datos sugiere que la vacuna es segura y eficaz para prevenir el COVID-19 sintomático en adultos", afirma el comunicado de prensa. "El DSMB informó que el candidato era seguro y bien tolerado y observó una tasa de eficacia de la vacuna del 94,5%".
Pfizer y BioNTech: El 18 de noviembre, un comunicado de prensa de Pfizer dijo que "hasta la fecha, el Comité de Monitoreo de Datos para el estudio no ha informado ningún problema de seguridad serio relacionado con la vacuna", citando una tasa de eficacia del 95%.
¿Que sigue?
Una vez que un DSMB concluye su revisión, la FDA asume el papel de revisar, evaluar y determinar si las vacunas son seguras y efectivas.
Un comité asesor de la FDA se reunió para discutir la vacuna EUA Moderna el 17 de diciembre y la vacuna EUA Pfizer-BioNTech el 10 de diciembre. Ambas reuniones fueron abiertas al público y transmitidas en YouTube.
La FDA no tiene que aceptar la recomendación del comité asesor, pero generalmente lo hace. Durante las audiencias del comité asesor, se hacen públicos datos de seguridad y eficacia más específicos revisados por los DSMB.
La FDA emitió un EUA para la vacuna Pfizer-BioNTech el 11 de diciembre y un EUA para la vacuna Moderna el 18 de diciembre.
Vacunas COVID-19: Manténgase actualizado sobre las vacunas disponibles, quién puede recibirlas y qué tan seguras son.
Por lo general, los grupos médicos y los gobiernos estatales y locales aceptan la decisión de la FDA con respecto a la efectividad y seguridad de una vacuna, pero la pandemia es un momento inusual. Algunos líderes gubernamentales y de salud están agregando revisiones adicionales para ayudar a aliviar los temores del público.La Asociación Médica Nacional, que representa a los médicos negros, anunció que ha designado un grupo de trabajo independiente para revisar cualquier medicamento o vacuna aprobados bajo una autorización de uso de emergencia.
El 22 de diciembre, el Grupo de Trabajo COVID-19 de la Asociación Médica Nacional emitió una declaración en apoyo de los EUA de la FDA para las vacunas Pfizer-BioNTech y Moderna. El grupo de trabajo anunció que había revisado los datos de los ensayos clínicos y encontró una eficacia y seguridad consistentes y un número y porcentajes suficientes de participantes negros para tener confianza en los resultados de salud.
Los gobernadores de California y Nueva York anunciaron que estaban organizando paneles de revisión independientes para cualquier vacuna COVID-19 que esté autorizada o aprobada por la FDA.
El grupo de trabajo de Nueva York apoyó unánimemente la vacuna Pfizer-BioNTech el 10 de diciembre y la vacuna Moderna el 18 de diciembre.
Washington, Nevada y Oregón se unieron a California para formar el Grupo de trabajo de revisión de seguridad científica de los estados occidentales, que anunció el apoyo a la vacuna Pfizer-BioNTech el 13 de diciembre y la vacuna Moderna el 20 de diciembre, y encontró que ambas son seguras y eficaces en sus revisiones.










.jpg)